Практ. 2
1. Взаимодействие хлороводородной и уксусной кислот со щелочами ( реакция нейтрализации).
Обе протекающие реакции – реакции нейтрализации. В ходе реакции среда в пробирке будет изменяться с кислой на нейтральную, а со средой будет меняться и окраска индикаторов: лакмуса с красной на фиолетовую, а метилоранж с розовой на оранжевую.
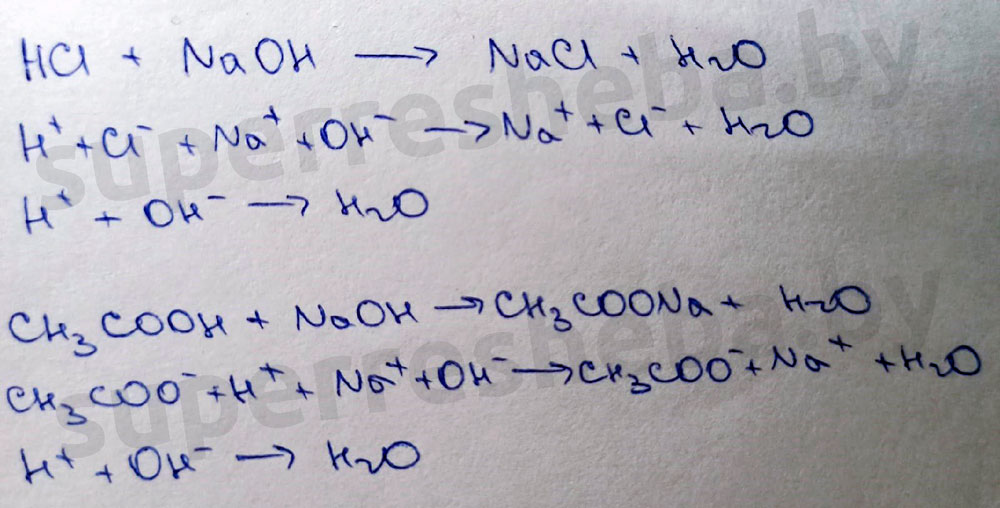
Ответ:
Нельзя. Фенолфталеин и в кислой, и в нейтральной среде бесцветный.
2. Взаимодействие хлороводородной и уксусной кислот с растворами карбоната натрия.
В ходе реакции выделяется углекислый газ, потому что обе кислоты сильнее угольной, и они вытесняют её из карбоната натрия с образованием углекислого газа и воды.
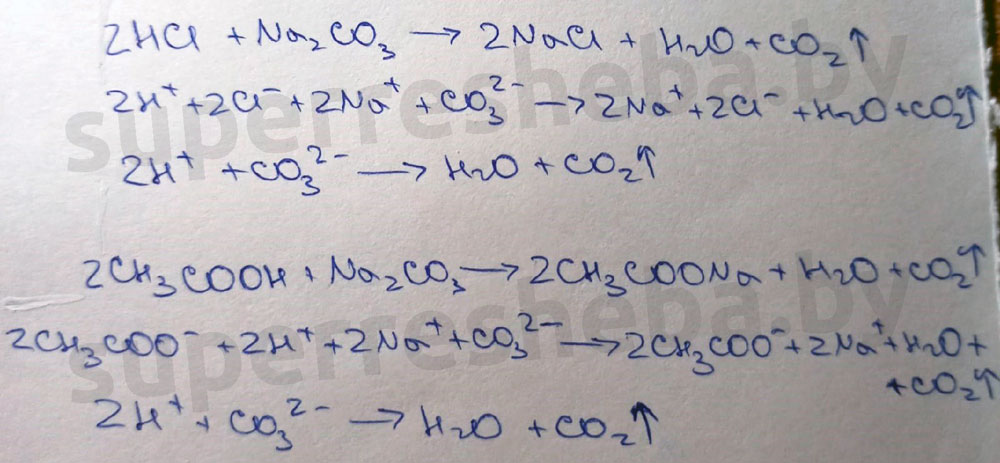
3. Взаимодействие хлороводородной и уксусной кислот с цинком.
В ходе обеих реакций образуются пузырьки газа — водород. Это характерный признак реакции металлов с кислотами. Т.к. в ходе реакции атом водорода в кислоте замещается на атом металла.
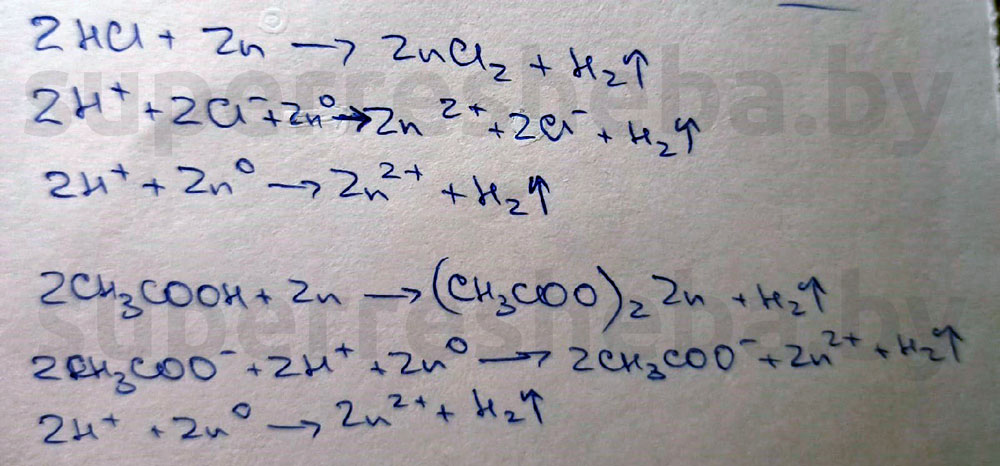
Ответ:
В пробирке с хлороводородной кислотой интенсивность выделения водорода выше, а это значит, что хлороводородная кислота сильнее.
4. Взаимодействие хлороводородной и уксусной кислот с оксидом меди (II).
В ходе реакции растворы будут становится голубого цвета, т.к. образующиеся соли меди (II) имеют голубой цвет.
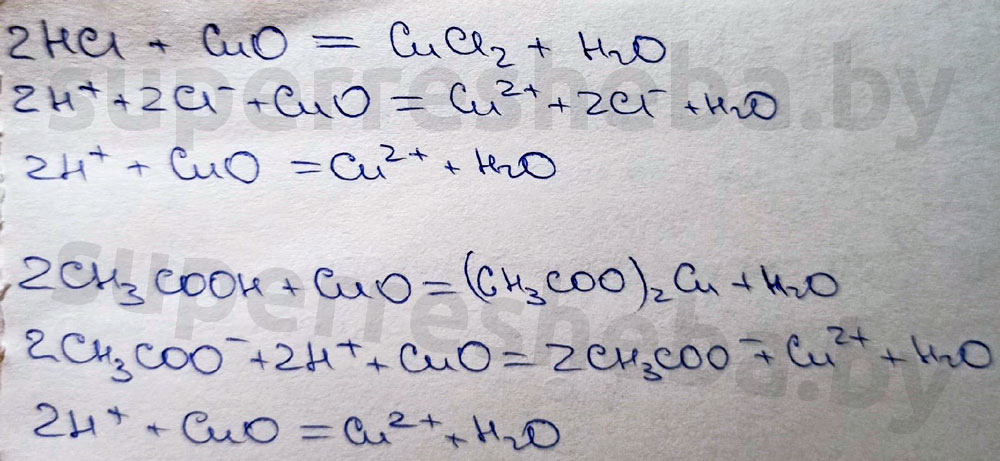
Ответ:
Соли меди в воде гидратируются, образуя аква-комплексы, которые имеют более интенсивное окрашивание.
5. Дополнительный эксперимент.
Индикаторная бумага будет краснеть, потому что фрукты и ягоды содержат свои собственные кислоты: апельсин — лимонную, яблоко — яблочную, виноград — виноградную и т.д.
6. Выводы. Напишите, с неорганическими соединениями каких классов взаимодействует уксусная и хлороводородная кислоты. В чем общность и в чём различие свойств хлороводородной и уксусной кислот? К каким электролитам — сильным или слабым — относятся эти кислоты?
Уксусная и хлороводородная кислоты взаимодействуют со щелочами, солями, металлами и оксидами металлов. Обе кислоты реагировали со всеми реактивами, но с разной интенсивностью. Уксусная кислота слабее, чем хлороводородная. Уксусная кислота — слабый электролит, а хлороводородная — сильный.