Лаб. 4
1. По результатам наблюдений составьте отчет о проделанных опытах. Заполните таблицу, в которой укажите интенсивность выделения водорода баллами: 0 - не выделяется, 1 - выделяется, 2 - выделяется активно.
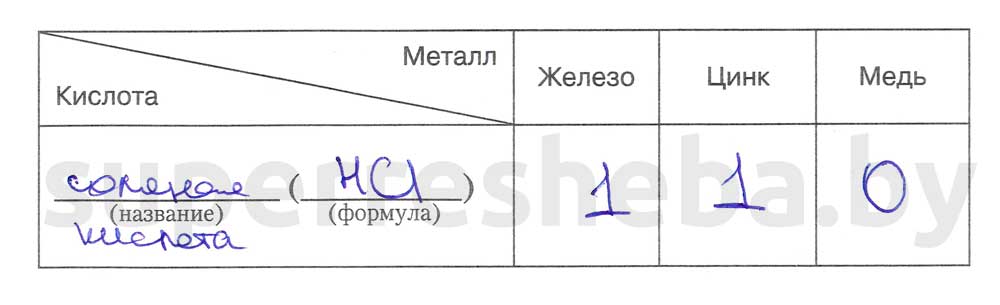
2. Составьте уравнения возможных химических реакций, укажите их тип, назовите продукты реакций.
Все реакции - реакции замещения.
3. Вывод. Сделайте вывод о проделанной работе, вставив в предложения пропущенные слова.
Кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода. Чем активнее металл, тем интенсивнее выделяется водород. Такие металлы, как Cu, Au, Ag, не взаимодействуют с кислотами, поэтому в ряду активности металлов расположены после водорода.
4. Задания
1.
а) ;
б) .
2.
а) медь;
б) магний; +
в) железо; +
г) золото;
д) алюминий. +
3.
5.