Практ. 3
1.
Вариант 1
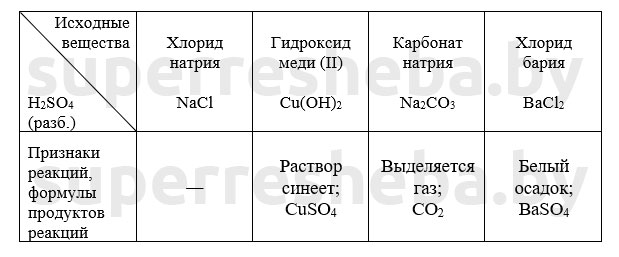
Уравнения химических реакций в молекулярном и сокращенном ионном виде:
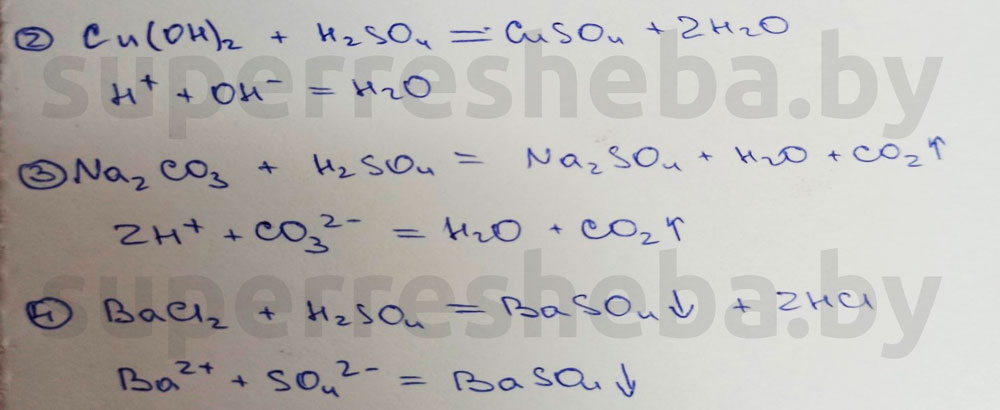
Вывод:
В протекающих реакциях ионы водорода играют связывающую роль. Они связывали гидрокид-ион с образованием воды, а карбонат-анион – с образованием угольной кислоты (угольная кислота сразу распадается на воду и углекислый газ).
Вариант 2
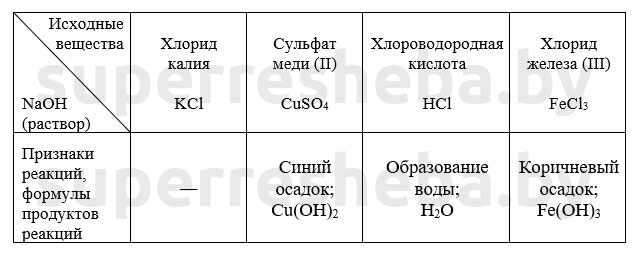
Уравнения химических реакций в молекулярном и сокращенном ионном виде:
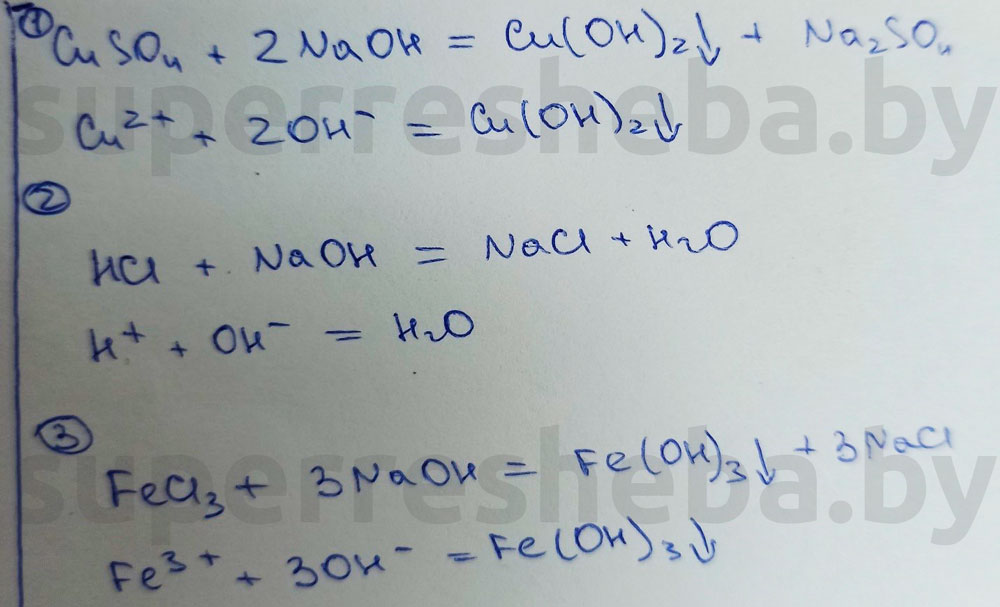
Вывод:
В протекающих реакциях гидроксид-ионы играют связывающую роль. Они связывали катионы металлов в нерастворимые осадка, а также ионы водорода с образованием воды.
2.
Вариант 1

Вывод:
Для того, чтобы можно было осуществить подобные реакции, необходимо, чтобы оба исходных вещества были растворимы или находились в расплаве, и, чтобы в ходе реакции эти вещества образовывали осадок или газ.
Вариант 2

Ответ:
Для того, чтобы можно было осуществить подобные реакции, необходимо, чтобы кислота, которой мы действуем на вещество, была сильнее кислоты, которой образована соль , также необходимо, чтобы в ходе реакции выделялся газ или образовывался слабый электролит.
3.
Вариант 1
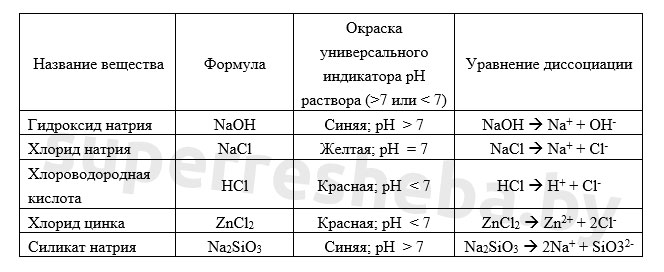
Уравнения возможных реакций обмена между солями и водой:
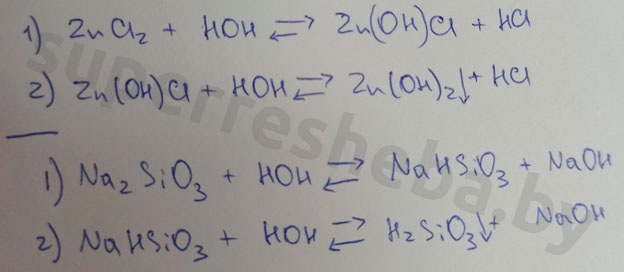
Вывод:
Значение pH зависит от отношения концентраций ионов и в растворе. Кислоты дают , щелочи , а соли могут давать и то, и то в результате гидролиза. Именно из-за гидролиза хлорид цинка и силикат натрия давали те или иные значения pH.
Вариант 2
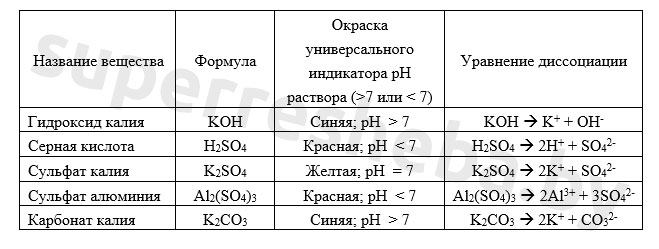
Уравнения возможных реакций обмена между солями и водой:
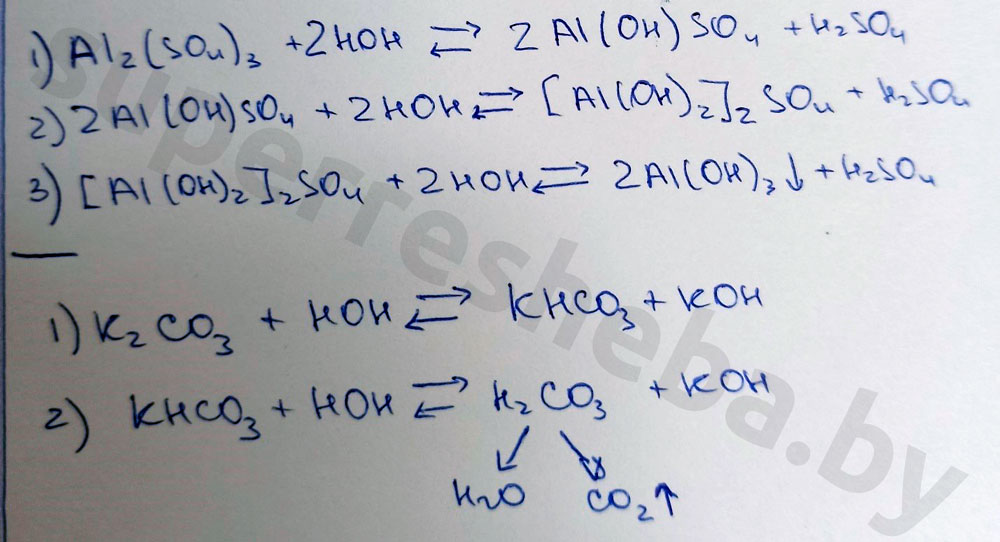
Вывод:
Значение pH зависит от отношения концентраций ионов и в растворе. Кислоты дают , щелочи , а соли могут давать и то, и то в результате гидролиза. Именно из-за гидролиза сульфат алюминия и карбонат калия давали те или иные значения pH.