Практ. 2
1. Изучение свойств кислот.
Задание 1.
1.
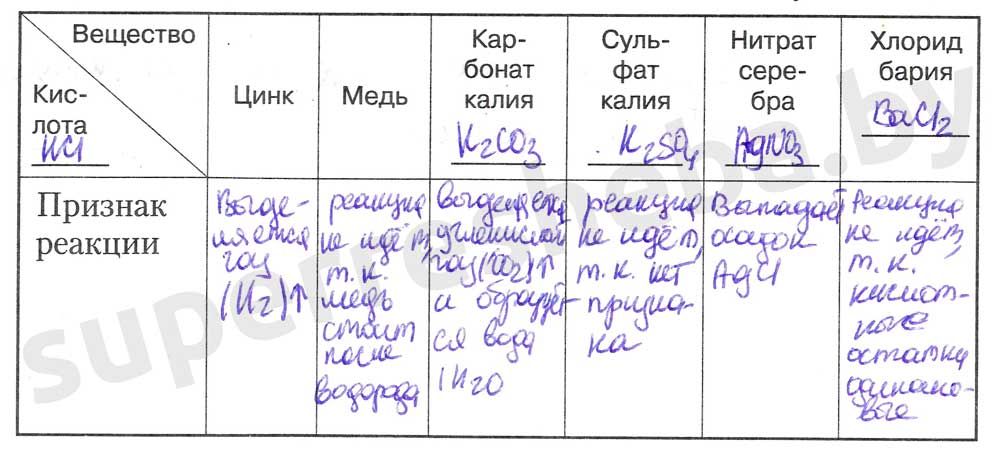
2.

Задание 2.
1.
После добавления гидроксида натрия концентрация уменьшилась.
Удалось ли вам нейтрализовать кислоту?
ДА
Потому что
В избытке осталась: ЩЕЛОЧЬ
2.
После реакции индикаторная бумага изменила цвет на красный, следовательно, кислота в избытке.
3.

4.Вывод.
Реакция нейтрализации - взаимодействие сильной кислоты и сильной щелочи между собой с образованием соли и малодиссоциирующего вещества (воды).
2. Изучение свойств щелочей.
Задание 1.
1.
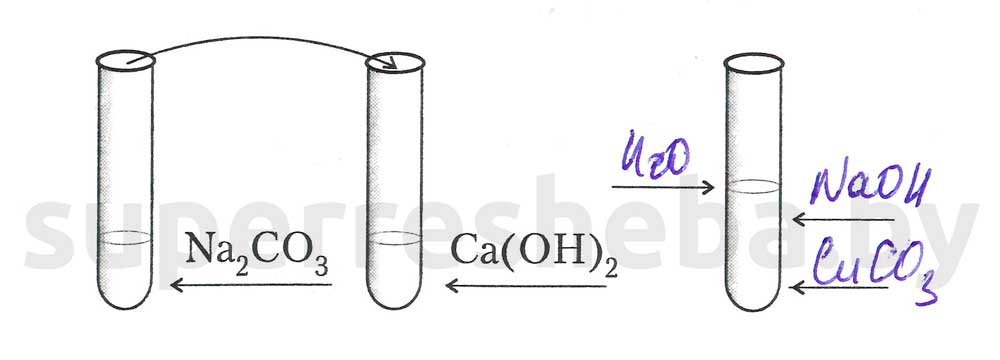
2.

Задание 2.
1.
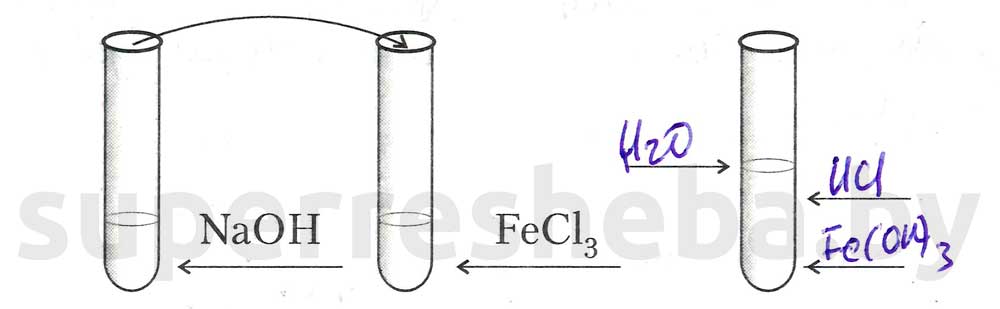
2.

3.
С точки зрения теории электролитической диссоциации свойства щелочей обусловлены наличием в их растворах гидроксид-ионов .
3. Изучение свойств солей.
Задание.
1.
Катионы меди в растворе связываются с образованием осадка с ионами . Для этого к раствору объемом сульфата меди (II) приливаем раствор , содержащий ионы . Выпадает осадок голубого цвета, вещество .
2.
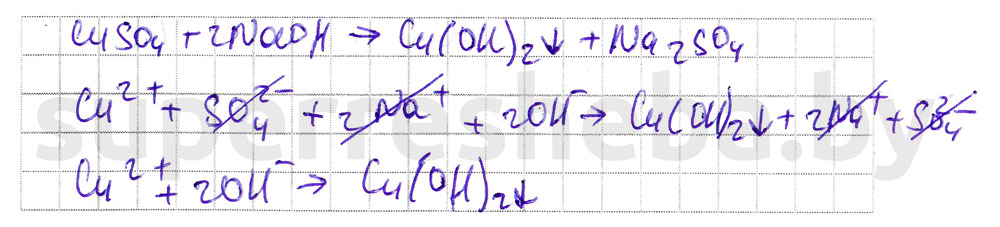
Дополните фразы, вставив пропущенные слова, формулы веществ или ионов.
Сульфат-ионы в растворе связываются с катионами с образованием осадка. Для этого к раствору сульфата меди (II) объемом приливаем раствор . Выпадает осадок белого цвета вещества, название которого сульфат бария.
3.

4.
Соли (как электролиты) взаимодействуют с металлами, кислотами, солью и щелочами.
В итоге образуются новые соли, основания, кислоты.
Эти реакции относятся к реакциям ионного обмена.
Соли вступают в ОВР.