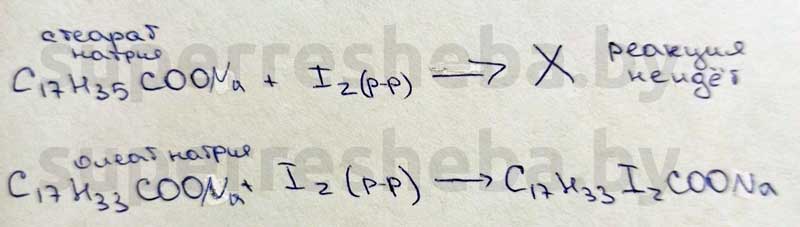Лаб. 6
1. Объясните наблюдаемые явления. Напишите уравнения реакции между стеаратом натрия и хлоридом магния в молекулярной и ионной формах.
Мыла – это соли натрия или калия и высших карбоновых кислот. В пробирке с мылом выпадает осадок и исчезает пена, потому что остатки высших карбоновых кислот образуют с ионами и нерастворимые соли.
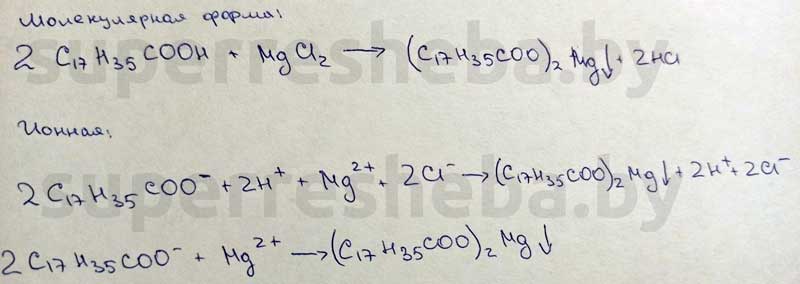
2. Примером синтетического моющего средства является лаурилсульфат натрия C12H25OSO2ONa. Остаток какой минеральной кислоты входит в состав лаурилсульфата натрия? Объясните, почему лаурилсульфат натрия не утрачивает моющего действия в присутствии ионов Mg2+.
Остаток лаурилсерной кислота входит в состав лаурилсульфата натрия. Лаурилсульфат ион при взаимодействии с Mg2+ не образует нерастворимого осадка, поэтому лаурилсульфат натрия не утрачивает моющего действия.
3. Приведите уравнение реакции трипальмитата глицерина с избытком водного раствора гидроксида калия при нагревании.

4. Рассчитайте массу трипальмитата глицерина, который потребуется для получения пальмитат калия массой 441 г по реакции, приведённой в задании 3, если выход продукта реакции равен 80%.
Дано:
Решение:
Ответ: 503,75 г.
5. Имеются две пробирки без этикеток. В одной пробирке находится водный раствор стеарата натрия, в другой – водный раствор олеата натрия. Как при помощи химической реакции определить, в какой пробирке какое вещество находится? Объясните наблюдаемые явления. Напишите уравнения реакции.
Для определения данных солей мы воспользуемся раствором иода. Олеат натрия имеет остаток олеиновой кислоты, а она содержит двойную связь. Обесцвечивание раствора иода — качественная реакция на двойную связь. Соль насыщенной карбоновой кислоты не будет вступать в эту реакцию.